La Radioprotection
Bienvenus dans le site de la radioprotection !
Comment se protéger de la radioactivité alors qu'on ne la voit pas ?
Quand on parle de radioactivité, on parle sans doute des noyaux atomiques. Et pour comprendre le phénomène de la radioactivité, il faut tout d'abord maîtriser les notions essentielles à propos des atomes.
L'atome (d'ordre de grandeur 10^-15) est le constituant fondamental de la matière. Il est la plus petite partie d'un corps simple, pouvant se combiner avec une autre. Il est constitué principalement de vide : on parle de structure lacunaire. Il est également constitué d'un nuage électronique et d'un noyau. Le nuage électronique est un ensemble d'électrons organisé en plusieurs couches. Le noyau, lui, est composé de deux particules distinctes : les protons (1 charges +, 1 masse) et les neutrons (0 charges, 1 masse).
Le nombre de protons dans le noyau est le numéro atomique
(noté Z). Il correspond également au nombre d'électrons en
orbite autour du noyau. Le nombre total de tous les nucléons
(protons + neutrons) est appelé nombre de masse (noté A).
L'atome est électriquement neutre, et c'est ce qui explique
le même nombre de protons que d'électrons. Le phénomène
de la radioactivité appartient à la physique nucléaire, ce qui
fait qu'on ne se concentrera que sur le noyau. Plusieurs atomes
dont les noyaux diffèrent par leur nombre de neutrons tout en
ayant le même nombre de protons sont appellés "Isotopes". Ils
appartiennent au même élèment chimique (par conséquent ils ont le même nom).
On distingue deux types d'Isotopes :
-- Les isotopes naturels : Ils existent dans la nature, comme l'Hydrogène ordinaire [H] (avec Z = 1) qui a deux isotopes, le deutérium [D], noyau stable (1 proton 1 neutron et on le trouve dans l'eau lourd D2O), et le tritium [T], noyau instable/radioactif (1 proton 2 neutrons) , ou l'Uranium naturel [U] (avec Z = 92) qui a deux isotopes tous les deux radioactifs, l'Uranium 238 (92 protons 146 neutrons, présent dans la nature à 99,3%) et l'Uranium 235 (92 protons 143 neutrons, présent dans la nature à 0,7 %). [D'autres exemples d'isotopes naturels]
-- Les isotopes artificiels : Ils n'existent pas dans la nature et on ne peut les fabriquer que dans des accélerateurs en bombardant des noyaux d'atomes stables avec des particules bien choisies. On obtient alors des noyaux instables, comme pour le cas de l'Iode 123 [I] (53 protons et 70 neutrons), isotope radioactif artificiel de l'Iode 127 (53 protons 74 neutrons). On peut donc remarquer que les isotopes peuvent être instables/radioactifs. Ce qui fait que la notion d'isotopie des atomes est nécessaire à la compréhension de la radioactivité. [D'autres exemples d'isotopes artificiels]
L'ensemble des noyaux-atomes stables ou instables avec tous les isotopes sont représenté dans un seul diagramme : c'est le diagramme de Segré.
Un noyau instable, dit radioactif, va chercher à tout moyen à gagner plus en matière de stabilité. Ainsi, il va se désinégrer. Un noyau ne peut se désintégrer qu'une seule fois. Un échatillon de x noyaux radioactifs vont voir leur quantité se diviser en deux en une période T bien précise appellée "Demi-vie".
Chaque élement possède une demi-vie différente.
Lors de sa désintégration, un noyau émet une particule accompagnée par un rayonnement de lumière. On distingue deux types de rayonnements de matières : Le rayonnement α (alpha) et le rayonnement β (bêta). La majorité du temps, ils sont accompagnés d'un rayonnement γ (gamma) électromagnétique.
-- Le rayonnement α (alpha) : Lors de la désintégration d'un noyau de type α, il y a expulsion d'un atome d'Hélium [He] (2 protons 2 neutrons). Ces particules émises ont une vitesse de 15000 Km/s et transportent beaucoup d'énergie cinétique (énergie liée au mouvement) . En somme, les particules d'Hélium 4 infligent des dégâts importants sur une distance très courte. Après avoir libérer un rayonnenment α, il y a transmutation de matière, c'est à dire le noyau radioactif perd deux protons ce qui fait qu'il change de numéro atomique et donc de nom.
-- Le rayonnement β (bêta) : Il est associé à la transformation d'un nucléon en deux particules : l'électron pour le rayonnement β - , ou le positron pour le rayonnement β +. La vitesse de ces particules émises est très élevée, atteignant 270 000 Km/s. Les particules β transportent une énergie cinétiques importantes sur une longue distance.
Le rayonnement β - provient de la désintégration d'un noyau radioactif qui est trop chargé de neutron et moins de proton. C'est pour cela qu'un neutron se transforme en proton en émettant un électron afin d'assurer l'équilibre du noyau.
Cependant, le rayonnement β + est l'inverse du β - . Il provient de la désintégration d'un noyau instable trop chargé de protons que de neutrons, ce qui fait qu'un proton se désintègre en neutron en émettant un positron.
-- Le rayonnement γ (gamma) : Ce rayonnement est le résultat d'une désexitation d'un noyau radioactif. Il diffère des autres par sa nature car contrairement aux α et β, le rayonnement γ est un rayonnement électromagnétique de même nature que la lumière visible.
L'Homme a réussi à créer dans des laboratoires, d'autres types de réactions nucléaires, différentes de l'alpha, bêta et gamma. En 1935, Irène et Frédéric Joliot-Curie ont bombardé une feuille d'aluminium avec des particules alpha, c'est-à-dire des noyaux d'Hélium 4. Ils ont obtenus un isotope radioactif du phosphore : le phosphore 30 (15 protons 15 neutrons). Cette réaction s'appelle une réaction nucléaire de fusion. Durant une réaction de fusion, deux noyaux légers s'associent pour en former un plus lourd, avec émission de neutrons.
Autre que la fusion, qui est synthétisée par l'Homme, on a la fission. C'est la dislocation d'un noyau lourd en deux noyaux plus légers avec émission de neutrons. Une des réactions nucléaires de fission les plus connus est celle de l'Uranium 235 :
Pour mieux comprendre ce phénomène mystérieux de la radioactivité, voici une video qui réusume cette partie :
efb
Le Principe de La Radioactivité.



Le diagramme de Segré regroupe tous les noyaux naturels ou artificiels. Il les classe selon le nombre de neutrons en fonction du nombre de protons. Tous ces noyaux forment une vallée dans le centre est appellé "vallée de stabilité"

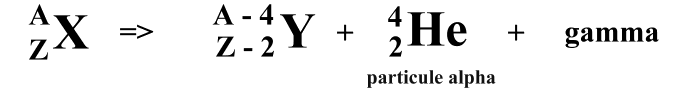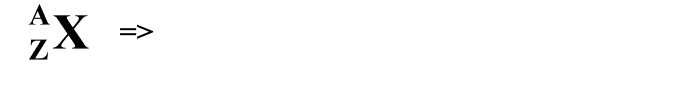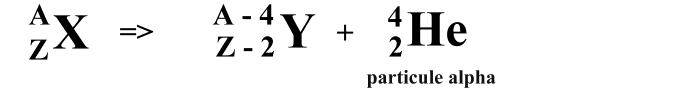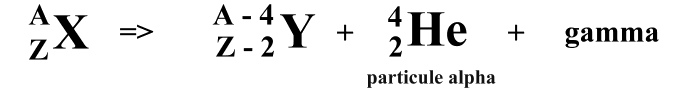

Je suis un paragraphe. Cliquez ici pour ajouter votre propre texte et modifiez-moi. Je suis l'endroit parfait pour raconter une histoire, et pour vous présenter à vos utilisateurs.
équation Beta +
équation Beta -
Un autre exemple de fusion : L'association du Deutérium (D) et du Tritium (T) nous donne un noyau d'Hélium 4 et un neutron.
équation alpha





